Fermento ypatumai: veiksmo rūšys ir ypatybės
Žodis "fermentas" turi lotynišką šaknį. Vertimas reiškia "raugą". Anglų kalba vartojamas terminas "fermentas", gautas iš graikiško termino, kuris reiškia tą patį. Fermentai vadinami specializuotais baltymais. Jie yra suformuoti ląstelėse ir turi galimybę pagreitinti biocheminių procesų eigą. Kitaip tariant, jie veikia kaip biologiniai katalizatoriai. Leiskite mums toliau svarstyti, kas yra fermentų veikimo specifiškumas. Specifiškumo tipai taip pat bus aprašyta straipsnyje.

Bendrosios charakteristikos
Kai kurių katalizinio aktyvumo pasireiškimasfermentus sukelia daugybė ne baltymų junginių. Jie vadinami cofactors. Jie skirstomi į 2 grupes: metalo jonus ir daugybę neorganinių medžiagų, taip pat kofermentus (organinius junginius).
Veiklos mechanizmas
Dėl savo cheminio pobūdžio yra fermentųbaltymų grupė. Tačiau, priešingai nei pastarasis, nagrinėjami elementai turi aktyvų centrą. Tai unikalus aminorūgščių likučių funkcinių grupių kompleksas. Jie yra griežtai orientuoti į erdvę dėl fermento tretinio arba ketvirčio struktūros. Aktyvioje centre kataliziniai ir substrato regionai yra izoliuoti. Pastarasis yra tai, kas lemia fermentų specifiškumą. Substratas yra medžiaga, kuria veikia baltymas. Anksčiau buvo manoma, kad jų sąveika vykdoma "rakto prie spyna" principu. Kitaip tariant, aktyvus centras turi aiškiai atitikti substratą. Šiuo metu vyrauja kita hipotezė. Manoma, kad iš pradžių nėra tikslios korespondencijos, tačiau tai atsiranda medžiagų sąveikos metu. Antrasis - katalizinis objektas - paveikia veiksmų specifiškumą. Kitaip tariant, ji nustato pagreitintos reakcijos pobūdį.

Struktūra
Visi fermentai yra suskirstyti į vieną irdviejų komponentų. Buvusi struktūra yra panaši į paprastų baltymų struktūrą. Jose yra tik aminorūgštys. Antroji grupė - baltymai - apima baltymų ir ne baltymų dalis. Paskutinis yra koenzimas, pirmasis - apoinizmas. Pastarasis nustato fermento substrato specifiškumą. Tai reiškia, kad aktyvus centras veikia kaip substratas. Coenzimas, atitinkamai, veikia kaip katalizinis regionas. Su juo susijusi veiksmų specifika. Kaip kofermentai gali veikti vitaminai, metalai ir kiti žemos molekulinės junginiai.
Katalizė
Susijusi su bet kuria chemine reakcijasąveikaujančių medžiagų molekulių susidūrimas. Jų judesį sistemoje lemia galimos laisvos energijos buvimas. Cheminės reakcijos atveju būtina, kad molekulės patvirtintų pereinamąją būseną. Kitaip tariant, jie turi turėti pakankamai jėgų, kad galėtų eiti per energijos barjerą. Tai reiškia minimalų energijos kiekį, kad visi molekuliai būtų reaguoti. Visi katalizatoriai, įskaitant fermentus, gali sumažinti energijos barjerą. Tai skatina paspartintą reakcijos eigą.

Kokia yra fermentų specifika?
Šis gebėjimas išreiškiamas tik pagreičiutam tikra reakcija. Fermentai gali paveikti tą pačią substratą. Tačiau kiekvienas iš jų pagreitins tik konkrečią reakciją. Reaktyvus fermento specifiškumas gali būti nustatytas kaip piruvatdehidrogenazės komplekso pavyzdys. Tai apima baltymus, kurie veikia PVC. Pagrindiniai iš jų: piruvatdehidrogenazė, piruvatdekarboksilazė, acetiltransferazė. Pati reakcija vadinama oksidaciniu dekarboksiliavimu iš PVC. Kadangi jo produktas veikia acto rūgštį.
Klasifikacija
Yra šie fermentų specifiškumo tipai:
- Stereocheminis. Tai išreiškiamas medžiagos gebėjimu daryti įtaką vienam iš galimų substrato stereoizomerų. Pavyzdžiui, fumarato hidratazė gali veikti fumaratu. Tačiau jis neturi įtakos cis-izomero-maleino rūgščiai.
- Absoliutus. Fermentų ypatumai Šis tipas išreiškiamas medžiagos gebėjimu paveikti tik tam tikrą substratą. Pavyzdžiui, sacharozė reaguoja tik su sacharozės, arginazės - su argininu ir pan.
- Santykinis. Fermentų ypatumai šiuo atveju išreiškiamas medžiagos gebėjimuįtaka substratų grupei, turinčiai tokio paties tipo jungtį. Pavyzdžiui, alfa-amilazė reaguoja su glikogenu ir krakmolu. Jie turi glikozidinio tipo jungtį. Trypsinas, pepsinas, chimotripsinas veikia daugelį peptidų grupės baltymų.

Temperatūra
Fermentai turi specifiškumą tam tikromis sąlygomis. Daugumai jų optimali temperatūra yra +35 ... + 45 laipsnių. Kai medžiaga yra dedama į sąlygas su mažesniais indeksais, jos veikla mažėja. Ši sąlyga vadinama grįžtama inaktyvacija. Kai temperatūra pakils, jo sugebėjimai bus atkurti. Verta pasakyti, kad jei nustatysite sąlygas, kuriose t yra didesnis už nurodytas vertes, taip pat bus ir inaktyvacija. Tačiau šiuo atveju tai bus negrįžtamas, nes jis neatsigauna mažėjant temperatūrai. Tai yra dėl molekulės denatūracijos.
PH poveikis
Molekulės įkrova priklauso nuo rūgštingumo. Atitinkamai, pH veikia aktyvios vietos aktyvumą ir fermento specifiškumą. Optimalus kiekvienos medžiagos rūgštingumo indeksas yra skirtingas. Tačiau daugeliu atvejų tai yra 4-7. Pavyzdžiui, alfa-seilių amilazės optimalus rūgštingumas yra 6,8. Tuo tarpu yra keletas išimčių. Optimalus pepsino rūgštingumas, pavyzdžiui, 1,5-2,0, chimotripsinas ir tripsinas - 8-9.

Koncentracija
Kuo daugiau yra fermento, tuo daugiaudidesnis reakcijos greitis. Panašią išvadą galima padaryti apie substrato koncentraciją. Tačiau teoriškai kiekvienai medžiagai nustatomas tirpiklio prisotinimas. Su juo visus aktyvius centrus užims esamas substratas. Šiuo atveju fermento specifiškumas bus maksimalus, neatsižvelgiant į tolesnį tikslų pridėjimą.
Medžiagos-reguliatoriai
Jie gali būti suskirstyti į inhibitorius ir aktyvatorius. Abi šios kategorijos yra suskirstytos į nespecifines ir specifines. Pastarojo tipo aktyvatorius yra žarnyno druskos (lipazei kasoje), chlorido jonai (alfa-amilazei), druskos rūgštis (pepsinui). Nespecifiniai aktyvatoriai yra magnio jonai, kurie veikia kinazius ir fosfatazes, o specifiniai inhibitoriai yra galiniai peptidai iš proenzimų. Pastarosios yra neaktyvios medžiagų formos. Jie aktyvuojami galutinių peptidų skilimu. Jų specifiniai tipai atitinka kiekvieną prozenzemą. Pavyzdžiui, neaktyvioje formoje trippsinas gaminamas tripsinogeno pavidalu. Jo aktyvus centras yra uždarytas su terminalo heksapeptidu, kuris yra specifinis inhibitorius. Įjungus procesą, jis atsinaujina. Aktyvus trypsino centras dėl to tampa atviras. Nespecifiniai inhibitoriai yra druskos iš sunkiųjų metalų. Pavyzdžiui, vario sulfatas. Jie sukelia junginių denatūraciją.
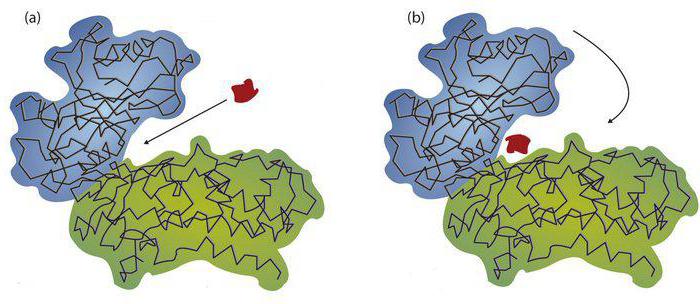
Slopinimas
Tai gali būti konkurencinga. Šis fenomenas yra išreikštas atsiradus struktūriniam slenksčio ir substrato panašumui. Jie pradeda kovą už bendravimą su aktyviu centru. Jei inhibitoriaus kiekis yra didesnis nei substrato kiekis, susidaro Coplex fermento inhibitorius. Kai pridedama tikslinė medžiaga, santykis pasikeičia. Dėl to inhibitorius bus pakeistas. Pavyzdžiui, sukcinatas sukcinato dehidrogenazei veikia kaip substratas. Tokie inhibitoriai yra oksaloacetatas arba malonatai. Reakcijos produktų įtaka yra laikoma konkurencinga. Dažnai jie yra kaip pagrindai. Pavyzdžiui, gliukozės-6-fosfato atveju produktas yra gliukozė. Substratas bus gliukozės-6 fosfatas. Nekonkurencingas slopinimas nereiškia struktūrinio medžiagų panašumo. Inhibitorius ir substratas gali vienu metu susieti su fermentu. Tai veda prie naujo junginio formavimosi. Jis yra sudėtingas fermento substrato inhibitorius. Sąveikos metu aktyvus centras blokuojamas. Taip yra dėl aktyviosios vietos katalizinės vietos inhibitoriaus prisijungimo. Pavyzdys yra citochromo oksidazė. Dėl šio fermento deguonis veikia kaip substratas. Citochromo oksidazės inhibitoriai yra cianido rūgšties druskos.

Allosterinis reglamentas
Kai kuriais atvejais, be aktyviojo centro,Fermento ypatybė yra dar viena nuoroda. Kaip alosterinis komponentas. Jei su tuo pačiu pavadinimu yra aktyvatorius, fermento veiksmingumas padidėja. Jei inhibitorius pateks į reakciją su alosterijos centru, atitinkamai sumažėja medžiagos aktyvumas. Pavyzdžiui, adenilatciklazė ir guanilato ciklazė nurodo fermentus, reguliuojančius alosterinio tipo.
</ p>


